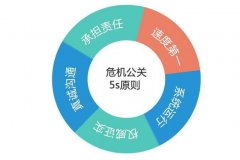
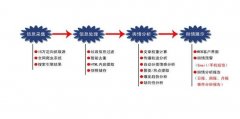
[专题]电影《银河补习班》危机公关公司有哪些
本篇文章1316字,读完约3分钟
近日,据英国媒体报道,瑞士制药巨头罗氏因隐瞒1.5万例死亡和6.5万例不良反应报告,涉及8种药物,被英国监管部门紧急调查。
罗氏的药物在中国有售
罗氏发表了一份关于隐瞒不良反应事件的声明,称“罗氏没有故意遗漏或评论相关数据,我们正在采取一系列措施,尽可能配合chpm的调查。我们已经提供了第一批关于漏报不良反应数量的估计,我们正在确认漏报的最终数量。”
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/4nsev0bslvrdyf9cdvedal8rk0rdjm.jpg)
7月11日,罗氏制药高级公关经理王华就罗氏在美国的患者救助项目遗漏不良事件向《中国经济时报》记者发出声明,声明显示,2012年1月和2月,欧盟卫生监管机构发现美国某患者救助项目的潜在不良事件未及时向卫生监管机构报告。媒体报道中提到的15,000起未进行安全性评估的不良事件仅限于美国的这一患者支持计划。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/ahu7w971o8zpme7e0vxbopz93xr9zj.jpg)
据报道,美国有8种药物涉及“未及时报告的潜在不良事件”,其中赫赛汀、特罗克尔和梅里图西马在中国销售。赫赛汀是世界上最畅销的抗癌药物之一,已在中国上市10年;Trocquer进入中国五年;米拉马尔早在2000年就进入中国市场,已经在中国上市12年了。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/w4xna3xe5xjye8wugwrdnyj6t5y27o.jpg)
目前,罗氏总部在美国拥有的8万份相关药物不良反应报告尚未确定是否应提供给欧洲食品药品监督管理局。这8万份报告中约有1.5万例死亡无法确定是否与罗氏药物直接相关。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/rnk1qny1ijsxf2u1gm6h1f3qa4ft2c.jpg)
业内人士认为,罗氏作为跨国公司,理应有跨国公司的责任和义务,但罗氏在不向监管部门报告的情况下查封了8万份不良反应报告,足以让公众对罗氏产生一定的信任危机。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/fij39rcdh4g9nuhbw38c8iarbqozso.jpg)
美国食品和药物管理局采访
据悉,罗氏已被要求在2012年6月27日前提供修订后的综合方案,以配合未来可能发生的药物不良反应事件的评估和报告,并确保能够采取正确的相应治疗方法。该计划包括对美国总部8万份病历的评估和对未来可能发生的后续事件的分析。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/hii0nvfbe0julfcuie0obws5ih1nae.jpg)
近日,国家食品药品监督管理局已开始调查相关情况。7月12日,国家食品药品监督管理局表示已约谈罗氏安全官,并指示罗氏报告事件评估结果;并向世界卫生组织和英国、美国的药品监管机构了解相关情况,希望及时通报事件的调查结果。同时,要加强对罗氏在中国销售的相关产品不良反应的监测。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/3qg14r9hp6l5fh7b8ic3s1t8spq5li.jpg)
对此,北京祁智未来营销咨询董事长李志奇认为,这一事件无疑会对罗氏整体品牌产生一定影响,但绝不是那么简单。事件背后其实有很多问题需要反思:比如为什么企业不愿意主动申报药品不良反应事件。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/9u7ppseb8oo2b173knyec0cxznwfb2.jpg)
早在1999年,我国就开始建立药品不良反应监测系统。同年12月,《药品不良反应监测管理办法》出台,但只是原则性规定,没有配套法律法规。2004年3月4日,卫生部、国家食品药品监督管理局发布了《药品不良反应及监测管理办法》。第一章第五条规定,国家鼓励有关单位和个人报告药品不良反应。隐瞒不良反应报告的,处以1000元以上3万元以下的罚款。2010年12月,修订了《药品不良反应报告和监测管理办法》,并于2011年7月1日实施。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/anzrz9kpkcx40mht9xz3s0sx2992sa.jpg)
卫生部全国合理用药监测网专家孙认为,罗氏没有将收集到的药品不良反应报告上报监管部门,这是跨国企业的作风损失,企业必须诚信为本。这件事给企业敲响了警钟。
![[专题]电影《银河补习班》危机公关公司有哪些 [专题]电影《银河补习班》危机公关公司有哪些](/uploads/diyimg/fvpp2wje40gr6n1584gcxe6cufxvw1.jpg)
李志说,药品不良反应一般是企业举报的。如果企业没有主动报告,或者没有发现任何药物不良反应,需要完善的应急和处罚措施来应对。
标题:[专题]电影《银河补习班》危机公关公司有哪些 地址:http://www.leixj.com/new/11485.html